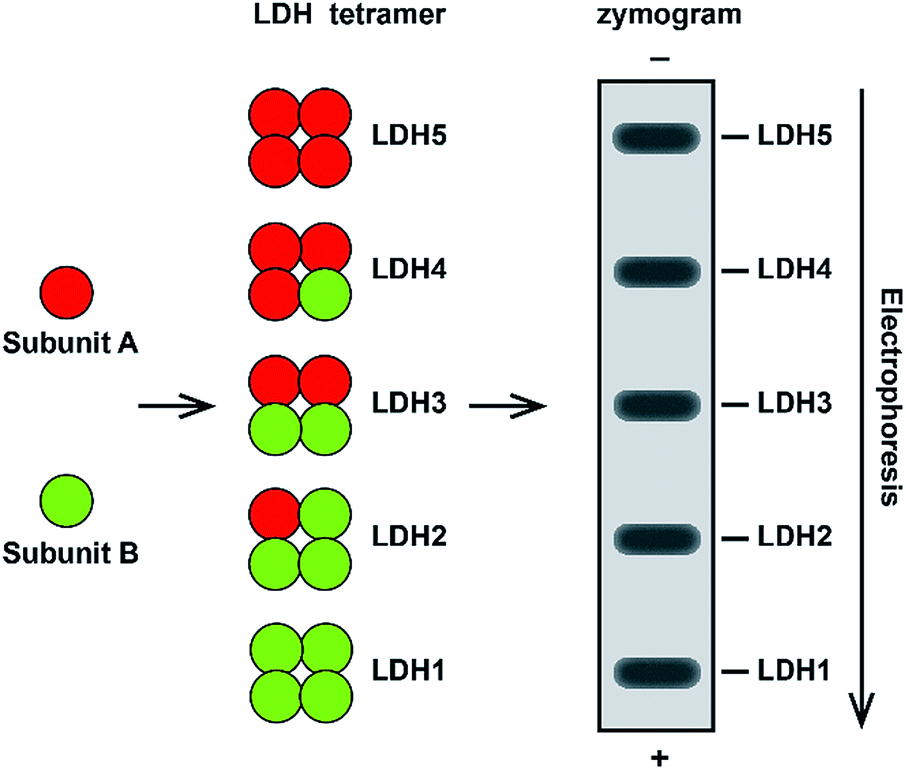
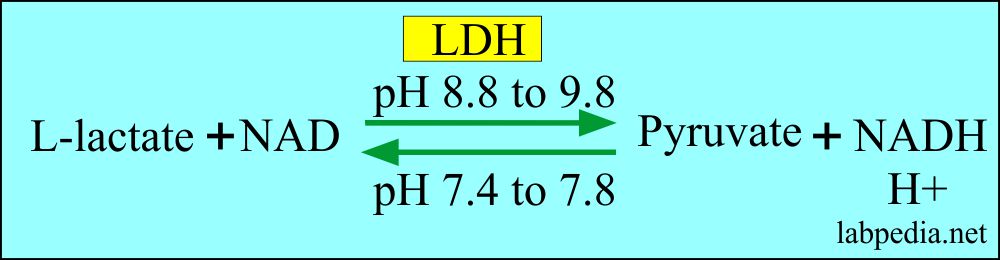
La lactato deshidrogenasa (lacto deshidrogenasa) es una enzima citoplasmática presente en las células de varios tejidos, liberándose en el plasma al momento que existe una herida tisular. Es poquísimo concreta de víscera, mas suele útil con el objetivo de detectar o bien constituir el pronóstico de ciertos problemas de salud. Los datos habituales habituales, expresados en piezas mundiales por litro, se encuentran comprendidos entre 100 y doscientos cuarenta UI/l, si bien hay siempre y en todo momento que referirse a los valores de refencia del laboratorio. Es posible ver alteraciones de las concentraciones de LDH: circadiana, durante el ciclo menstrual y según la edad; no obstante, estas fluctuaciones no afectan a la interpretación de los resultados. La lacto deshidrogenasa incluye 5 isoenzimas que tienen posibilidad de diferenciar a través de electroforesis o bien cromatografía en función de su velocidad de migración.
La disposición de las isoenzimas de la LDH en los tejidos se muestra en la tabla 1.
La determinación de las focalizaciones de la isoenzima es posible, mas no se realiza habitualmente en Atención Primaria.
Tabla 1.- Distribución de las isoenzimas de la lactato deshidrogenasa (lacto deshidrogenasa) en los tejidos. La actitud ante una elevación de los criterios plasmáticos de lacto deshidrogenasa entiende tres etapas sucesivas: descartar una hemólisis durante la extracción sanguínea, estimar un proceso de lisis celular y descartar un Procedencia neoplásico. Descartar hemólisis a lo largo de la extracción de la muestra de sangre. Al estar la LDH extensamente presente en todas y cada una de las células sanguíneas circulantes, la hemólisis (debida a la extracción de la muestra) suele provocar una falsa elevación de las concentraciones de LDH. Por tanto, es necesario pensar en ello y descartarla ya antes de proseguir con cualquier procedimiento diagnóstico. En estos asuntos, la resolución de LDH no permite por sí sola establecer el diagnóstico etiológico. La orientación diagnóstica se establecerá a través de la anamnesis y exploración clínica orienyada, y se completará a través de realización de estudios complementarios.
Anemias hemolíticas. La debilidad con palidez, taquicardia, dolor de la espalda baja y hemoglobinuria suele indicar clínicamente hacia una hemólisis. Las exploraciones se terminan con un hemograma completo, reticulocitos, determinación de haptoglobina y bilirrubina no conjugada, así como a través de un frotis sanguíneo. En el caso de una hemólisis comprobada, la determinación de la LDH también puede resultar útil para el seguimiento. En los pacientes con anemia de células falciformes, la determinación fácil y rápida de las concentraciones de lacto deshidrogenasa resulta realmente útil en la práctica clínica para diagnosticar un acceso vasooclusivo y valorar su intensidad, de este modo como para confirmar su resolución. Por otra parte, su elevación tras una transfusión debe hacer temer un accidente hemolítico transfusional. Procedencia cardíaco. Las concentraciones de LDH pueden estar enaltecidas en la isquemia miocárdica ocasionada por los síndromes coronarios y las miocarditis. Por lo tanto, ante una lacto deshidrogenasa elevada se deberá indagar sobre la notoriedad de factores de riesgo cardiovascular (años, hipertensión arterial, dislipidemia, diabetes, gordura, tabaquismo, herencia) y la presencia de dolor en el tórax es clave para realizar un electrocardiograma (ECG) y la determinación de las enzimas miocárdicas (troponina y creatina fosfocinasa (CPK)). La elevación de las concentraciones de estas enzimas es más concreta y más precoz que la de las focalizaciones de lacto deshidrogenasa, en tanto que esta no se halla elevada hasta después de un periodo de diez-12 horas tras el infarto de miocardio. Ello hace que no sea una enzima útil en el diagnóstico precoz. Su elevación presenta un pico a las 72 horas y persiste hasta 14 días, lo que tampoco permite el seguimiento de la resolución del episodio. Además de los síndromes coronarios, hay que indicar que los traumatismos cardiacos o bien las cardioversiones eléctricas asimismo pueden producir un aumento de la LDH.
Origen muscular. condiciones directamente relacionadas con lisis de las células musculosas (rabdomiólisis) tienen posibilidad de ser causante de la elevación de los criterios de lacto deshidrogenasa: sostenerse de forma prolongada en el suelo tras una caída, traumatismo, inyección intramuscular, administración de un fármaco con toxicidad muscular, como las estatinas, enfermedad muscular innata (distrofia muscular de Duchenne) o bien inflamatoria (tales como polimiositis o bien dermatomiositis). En estos casos, la elevación de las focalizaciones de LDH suele ir en compañía de de la elevación conjunta de las focalizaciones de CPK, aspartato aminotransferasa (ASAT) y, en ocasiones, aldolasa. Origen hepático. El antecedente de un viaje a zonas de riesgo, de signos digestivos o bien de administración de un fármaco, así tales como la elevación de los niveles de LDH puede guiar al clínico cara una hepatitis aguda. En un caso así, el estudio incluye la determinación de las enzimas hepatobiliares (GOT, GPT, GGT, fosfatasa alcalina, bilirrubina total y libre, tales como el tiempo de protrombina y la albúmina. El estudio etológico se lleva a cabo en función de la situación clínica. Algunas patologías hepáticas crónicas (cirrosis, metástasis hepáticas, etc.) asimismo pueden acompañarse de la elevación de la LDH.
Origen pulmonar. El embolismo pulmonar puede cursar con elevación de la lacto deshidrogenasa. En el caso de sospecha diagnóstica, el contexto, los datos del ECG y los gases en sangre deben orientar al clínico hacia la realización de una prueba de imagen pulmonar. Ciertas enfermedades y neoplasias pulmonares asimismo tienen posibilidad de acompañarse del incremento de las concentraciones de lacto deshidrogenasa. En la fibrosis pulmonar idiopática, los factores de mal pronóstico de exacerbación respiratoria aguda incluyen las focalizaciones de lacto deshidrogenasa. Asimismo, se ha propuesto que una concentración sanguínea elevada de lacto deshidrogenasa (particularmente de la isoenzima LDH3) suele constituir un medio sencillo de detección de la tuberculosis en las poblaciones de peligro que no tienen acceso a las pruebas microbiológicas. Además de esto, en pacientes afectados por el VIH (VIH), concentraciones plasmáticas más elevadas de LDH podrían ir más en favor de una infección pulmonar de Procedencia tuberculoso que de otra micobacteria. Procedencia nefrítico. El infarto nefrítico, acompañado de sufrimiento de la espalda baja y hematuria, genera la incrementación de la LDH.
Origen digestivo. El infarto mesentérico asimismo cursa con un incremento de las focalizaciones de lacto deshidrogenasa. La semiología suele estar disociada y cambia conforme la etiología (cardioembolígena, ateromatosa, venosa o no oclusiva). La angiotomografía computarizada (angio-TC) abdominal puede asistir a establecer el diagnóstico. También es posible ver el aumento de los niveles de CPK, amilasa o bien enzimas hepáticas o una acidosis con hiperlactatemia. Para finalizar, la pancreatitis aguda también se acompaña de elevación de las concentraciones de LDH, que penaliza el cálculo de la puntuación de pronóstico de Ranson cuando es superior a 1,5 veces el valor normal.
Origen infeccioso. Los criterios de LDH se elevan de manera frecuente durante las sepsis. Podrían formar un marcador de gravedad en infecciones tan banales como graves. La proliferación celular neoplásica se acompaña de un aumento de la muerte celular, lo que provoca la manumisión de LDH. Las focalizaciones de lacto deshidrogenasa pueden constituir, de esta manera, un destello de la masa tumoral. La LDH aumenta en todas las enfermedades hematológicas proliferativas (linfomas, leucemias, mieloma, etcétera y en muchos cánceres sólidos, como algunos tipos de cáncer de testículo, llegando a ser recomendada su determinación conjunta con AFP y Beta-HCG en su diagnóstico y seguimiento, cáncer de ovario, sarcoma de Ewing, melanoma, neuroblastoma, etcétera Si bien la incrementación tiene un valor clínico limitado, por la elevada tasa de falsos positivos, en caso de duda es necesario practicar una prueba de imagen anatómico total o, aun, una gammagrafía con fluorodesoxiglucosa marcada (PET-TAC).
También en oncología, la determinación de las concentraciones de LDH tiene interés de cara al pronóstico o bien ser útil en el seguimiento de ciertas neoplasias. En el cáncer colorrectal múltiples índices pronósticos incorporan las concentraciones de lacto deshidrogenasa, que forma, por tanto, un biomarcador del mismo tipo que el antígeno carcinoembrionario. Las focalizaciones de lacto deshidrogenasa también pueden guiar el uso de las inmunoterapias, tales como el bevacizumab en el procedimiento de cáncer colorrectal metastásico, puesto que, en un estudio reciente, se resalta que los pacientes con las concentraciones de lacto deshidrogenasa más altas son aquellos que se favorecen en mayor medida de este procedimiento en concepto de calidad de vida. Asimismo en el melanoma metastásico los criterios de lacto deshidrogenasa guían el beneficio a largo plazo de la utilización de la inmunoterapia. Por último, la lacto deshidrogenasa también se ha transformado en un tema de actualidad en oncología, ya que se se encuentran desarrollando terapias dirigidas a la inhibición de la actividad de la LDH, en las que el crecimiento del tumor, desprovisto de este modo de energía, puede retrasarse en gran medida.
Tabla dos. Enfermedades que cursan con elevación del lactato deshidrogenasa. Anemias hemolíticas: Anemia de células falciformes, hemoglobinuria paroxística nocturna, anemias microangiopáticas, síndrome hemolítico urémico, postransfusión sanguínea. Trastornos cardíacos: Infarto agudo de miocardio, miocarditis, traumatismo cardiaco, cardioversión eléctrica. Trastornos musculosas: Distrofias musculosas, trauma muscular, miopatías metabólicas e inflamatorias. Neoplasias Linfomas no Hodgkin, linfoma de Burkitt, carcinoma nasofaríngeo, disgerminoma, tumores germinales mixtos (disgerminomas), sarcoma retroperitoneal, cáncer de próstata, osteosarcoma, sarcoma de Ewing, melanoma cutáneo. Leucemias: Leucemia linfoblástica aguda, L. linfocítica crónica, L. mielomonocítica crónica. En la leucemia mieloide crónica y en el mieloma múltiple, la resolución de las concentraciones de LDH, destello de la masa tumoral, es parte de los factores de pronóstico clásico. Trastornos neumológicos: Sarcoidosis pulmonar, tromboembolismo pulmonar, empiema complicado. Cuadros inflamatorios Artritis reumatoidea juvenil complicada, trastornos reumáticos agudos. Hepatopatías: Hepatitis virica, insuficiencia hepática, cirrosis hepática, hepatitis isquemica.






 Un componente de la proteína se descompone como parte del metabolismo normal. El gen PAH proporciona instrucciones para una enzima importante en este proceso, la fenilalanina hidroxilasa.
Un componente de la proteína se descompone como parte del metabolismo normal. El gen PAH proporciona instrucciones para una enzima importante en este proceso, la fenilalanina hidroxilasa.
 Si los síntomas sugieren que una persona puede tener mieloma múltiple, se hacen pruebas adicionales. El hemograma completo es una prueba que mide los niveles de glóbulos rojos, glóbulos blancos y plaquetas en la sangre. Si existen demasiadas células de mieloma en la medula ósea, los niveles de algunas de estas células sanguíneas pueden estar bajos. El descubrimiento más frecuente es un recuento bajo de glóbulos rojos (anemia). Se comprobarán los niveles de creatinina, albúmina, calcio y otros electrolitos. Los niveles de creatinina indican qué tan bien marchan sus riñones. Los niveles elevados significan que los riñones no marchan bien. Esto es común en las personas con mieloma. La albúmina es una proteína que se encuentra en la sangre. En las personas con mieloma, se pueden presentar niveles bajos de albúmina. Además, las personas con mieloma avanzado pueden presentar niveles elevados de calcio. Los niveles elevados de calcio (hipercalcemia) pueden causar síntomas de cansancio, debilidad y confusión. También se debe hacer una prueba sanguínea para medir los niveles de deshidrogenasa láctica
Si los síntomas sugieren que una persona puede tener mieloma múltiple, se hacen pruebas adicionales. El hemograma completo es una prueba que mide los niveles de glóbulos rojos, glóbulos blancos y plaquetas en la sangre. Si existen demasiadas células de mieloma en la medula ósea, los niveles de algunas de estas células sanguíneas pueden estar bajos. El descubrimiento más frecuente es un recuento bajo de glóbulos rojos (anemia). Se comprobarán los niveles de creatinina, albúmina, calcio y otros electrolitos. Los niveles de creatinina indican qué tan bien marchan sus riñones. Los niveles elevados significan que los riñones no marchan bien. Esto es común en las personas con mieloma. La albúmina es una proteína que se encuentra en la sangre. En las personas con mieloma, se pueden presentar niveles bajos de albúmina. Además, las personas con mieloma avanzado pueden presentar niveles elevados de calcio. Los niveles elevados de calcio (hipercalcemia) pueden causar síntomas de cansancio, debilidad y confusión. También se debe hacer una prueba sanguínea para medir los niveles de deshidrogenasa láctica